
엔탈피와 엔트로피는 열역학의 핵심 개념으로, 다양한 물리적, 화학적 과정에서 중요한 역할을 합니다. 이 글에서는 엔탈피와 엔트로피의 정의, 차이점, 관계점, 그리고 실제 응용 사례를 포함하여 자세히 설명하겠습니다
엔탈피 (Enthalpy)
엔탈피의 정의
엔탈피(Enthalpy)는 시스템이 보유한 총 에너지를 나타내는 열역학적 상태 함수입니다. 이는 내부 에너지(U)와 압력(P) 및 부피(V)의 곱을 합한 값으로 정의됩니다:
H = U + PV
엔탈피의 단위와 기호
엔탈피는 주로 킬로줄(kJ) 또는 줄(J)로 측정되며, 기호로 H를 사용합니다.
엔탈피 변화 (ΔH)
화학 반응이나 물리적 변화에서 엔탈피 변화는 반응 전후의 엔탈피 차이로 나타납니다:
ΔH = H(생성물) – H(반응물)
엔탈피 변화는 발열 반응과 흡열 반응에서 중요합니다. 발열 반응에서는 엔탈피가 감소(ΔH < 0)하고, 흡열 반응에서는 엔탈피가 증가(ΔH > 0)합니다.
엔트로피 (Entropy)
엔트로피의 정의
엔트로피(Entropy)는 시스템의 무질서도 또는 에너지 분산 정도를 나타내는 상태 함수입니다. 이는 시스템의 미시 상태(Microstate)의 수와 관련되어 있습니다.
엔트로피의 단위와 기호
엔트로피는 주로 줄 퍼 켈빈(J/K) 단위를 사용하며, 기호는 S입니다.
엔트로피 변화 (ΔS)
엔트로피 변화는 시스템이 열을 흡수하거나 방출할 때 발생하는 변화로, 다음과 같이 정의됩니다:
ΔS = Q(rev) / T
여기서 Q(rev)는 가역 과정에서 교환되는 열량이고, T는 절대 온도입니다.
엔탈피와 엔트로피의 차이점
에너지의 형태
엔탈피는 시스템의 내부 에너지와 압력-부피 작업을 포함한 총 에너지를 나타내며, 엔트로피는 시스템의 무질서도 또는 에너지 분산 정도를 나타냅니다.
단위
엔탈피의 단위는 에너지의 단위인 줄(J) 또는 킬로줄(kJ)이고, 엔트로피의 단위는 줄 퍼 켈빈(J/K)입니다.
열역학 법칙
엔탈피는 주로 열역학 제1법칙(에너지 보존 법칙)에 의해 설명되며, 엔트로피는 열역학 제2법칙(엔트로피 증가 법칙)에 의해 설명됩니다. 엔탈피는 에너지의 보존과 이동에 중점을 두고, 엔트로피는 시스템의 자발적 변화와 무질서도의 증가를 설명합니다.
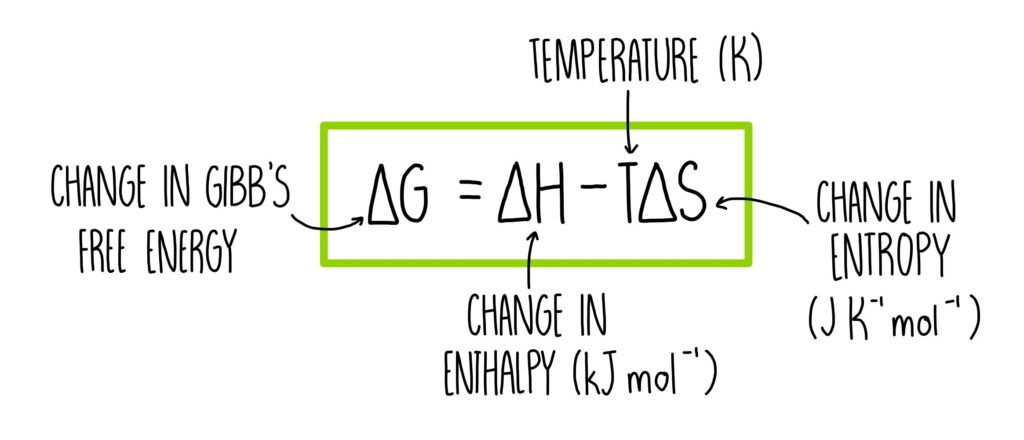
엔탈피와 엔트로피의 관계
엔탈피와 엔트로피는 자유 에너지 함수, 특히 깁스 자유 에너지(Gibbs free energy, G)와 헬름홀츠 자유 에너지(Helmholtz free energy, A)를 통해 밀접하게 연결됩니다.
깁스 자유 에너지 (G)
깁스 자유 에너지는 일정한 온도와 압력 조건에서 시스템이 할 수 있는 최대 일을 나타냅니다:
G = H – TS
여기서 T는 절대 온도, S는 엔트로피입니다.
헬름홀츠 자유 에너지 (A)
헬름홀츠 자유 에너지는 일정한 온도와 부피 조건에서 시스템이 할 수 있는 최대 일을 나타냅니다:
A = U – TS
여기서 U는 내부 에너지, T는 절대 온도, S는 엔트로피입니다.
자발성 판단
깁스 자유 에너지의 변화 (ΔG)는 반응의 자발성을 판단하는 중요한 지표입니다. 반응이 자발적으로 일어나기 위해서는 ΔG가 음수여야 합니다:
ΔG = ΔH – TΔS
여기서 ΔH는 엔탈피 변화, ΔS는 엔트로피 변화, T는 절대 온도입니다.
엔탈피와 엔트로피의 실제 사례
발열 반응과 흡열 반응
발열 반응에서는 엔탈피가 감소하고(ΔH < 0), 주위에 열을 방출합니다. 예를 들어, 연소 반응에서는 연료가 산소와 반응하여 이산화탄소와 물을 생성하면서 열을 방출합니다.
흡열 반응에서는 엔탈피가 증가하고(ΔH > 0), 주위에서 열을 흡수합니다. 예를 들어, 얼음이 녹아서 물이 되는 과정은 흡열 반응입니다.
물질의 상태 변화
물질의 상태 변화는 엔탈피와 엔트로피의 변화를 수반합니다. 예를 들어, 얼음이 물로 녹는 과정에서는 엔탈피가 증가하고 엔트로피도 증가합니다. 이는 얼음이 고체 상태에서 액체 상태로 변하면서 분자 간의 무질서도가 증가하기 때문입니다.
화학 반응의 자발성
화학 반응이 자발적으로 일어날지 여부는 깁스 자유 에너지 변화를 통해 판단할 수 있습니다. 예를 들어, 금속 나트륨이 물과 반응하여 수산화나트륨과 수소 기체를 생성하는 반응은 자발적입니다. 이 반응에서는 엔탈피가 감소하고 엔트로피가 증가하여 전체적으로 깁스 자유 에너지가 감소합니다.
엔탈피와 엔트로피의 중요성
화학 반응의 예측
엔탈피와 엔트로피는 화학 반응의 자발성을 예측하고 반응 경로를 설계하는 데 중요합니다. 엔탈피 변화는 반응이 발열인지 흡열인지 알려주며, 엔트로피 변화는 반응의 무질서도 변화를 나타냅니다.
공학적 응용
엔탈피와 엔트로피는 공학 분야에서도 중요한 역할을 합니다. 예를 들어, 엔탈피는 열교환기, 보일러, 냉각기 등 열역학적 시스템의 설계와 운영에 사용됩니다. 엔트로피는 엔진, 냉동기, 열펌프 등의 효율성을 평가하고 최적화하는 데 사용됩니다.
자연 현상 이해
엔탈피와 엔트로피는 자연 현상을 이해하는 데 필수적인 개념입니다. 예를 들어, 기상학에서 기온 변화, 대기 압력, 습도 등의 변화를 설명하는 데 사용됩니다. 생명 과학에서는 생물체의 대사 과정, 에너지 흐름, 세포 활동 등을 설명하는 데 중요합니다.
엔탈피와 엔트로피의 추가적인 사례와 응용
에너지 저장 및 변환
에너지 저장 시스템에서는 엔탈피와 엔트로피의 개념이 매우 중요합니다. 예를 들어, 배터리와 연료 전지에서 에너지 저장 및 변환 과정은 엔탈피와 엔트로피의 변화에 의해 설명될 수 있습니다. 배터리의 충전 및 방전 과정에서 발생하는 열과 에너지 분산을 이해하면 효율적인 에너지 관리가 가능합니다.
생화학적 반응
생화학적 반응에서도 엔탈피와 엔트로피는 중요한 역할을 합니다. 예를 들어, ATP 합성 및 분해 과정에서는 에너지의 저장 및 방출이 엔탈피와 엔트로피 변화에 의해 결정됩니다. 이는 생물체의 에너지 대사와 생명 유지에 필수적입니다.
재료 과학 및 공학
재료 과학에서는 새로운 재료의 개발과 특성 분석에 엔탈피와 엔트로피의 개념이 사용됩니다. 예를 들어, 합금의 형성, 결정 구조의 안정성, 상변화 등의 연구에서 엔탈피와 엔트로피는 중요한 역할을 합니다. 이러한 연구는 더 나은 재료를 개발하고 응용하는 데 기여합니다.

결론
엔탈피와 엔트로피는 열역학의 핵심 개념으로, 다양한 물리적, 화학적 과정에서 중요한 역할을 합니다. 엔탈피는 시스템의 총 에너지를 나타내며, 주로 열과 일의 전환 과정을 설명합니다. 엔트로피는 시스템의 무질서도 또는 에너지 분산 정도를 나타내며, 자발적 변화의 방향성을 예측합니다. 두 개념은 깁스 자유 에너지와 헬름홀츠 자유 에너지와 같은 자유 에너지 함수로 밀접하게 연결되며, 화학 반응, 물질 상태 변화, 공학적 설계, 자연 현상 이해 등 다양한 분야에서 활용됩니다.
엔탈피와 엔트로피를 잘 이해함으로써 우리는 에너지 변환 과정과 자연 현상의 본질을 더 깊이 이해할 수 있으며, 이를 통해 과학적, 공학적 문제를 효과적으로 해결할 수 있습니다.